Wat is de rol van microbloedstolsels bij het ontstaan van Long COVID
Auteur: Eefje van ‘t Hof
mei 2023
Op internet of op “social media” lees je vaak iets over de rol van mini bloedstolsels bij Long COVID (LC). Hoe zit dat nu precies met deze klontertjes in het bloed bij LC-patiënten?
Ook de eerdergenoemde 2 review artikelen (1,2) noemen diverse studies waarin vaatafwijkingen bij LC-patiënten zijn gezien, zoals een verhoogd risico van trombose, longembolie en andere hart- en vaatziekten. Bij deze patiënten ziet men vaak hele kleine microstolsels. Deze kunnen weer een impact hebben op de doorbloeding van allerlei organen (1,2). Ook zijn er eerste aanwijzingen gevonden die suggereren dat er een verband bestaat tussen de ernst van sommige LC-symptomen (zoal cognitieve problemen) en het aantal microstolsels (2). Benieuwd hoe deze microstolsels ontstaan, waar ze vandaan kunnen komen en hoe ze LC-symptomen kunnen veroorzaken? Hieronder leggen we uit wat er tot nu toe bekend is over dit onderwerp. De tekst is voor een groot deel gebaseerd op een overzichtsartikel van Janna Moen (3) en een artikel gepubliceerd in National Geographic (7).
Bloedstolling in een gezond lichaam
De bloedstolling in ons lichaam volgt een delicate balans tussen het tegengaan van stolselvorming in gezond weefsel, het bevorderen van stolling tijdens acuut letsel en het afbreken van onnodige stollingsproducten. Hoe werkt normaliter dit stollingsproces?
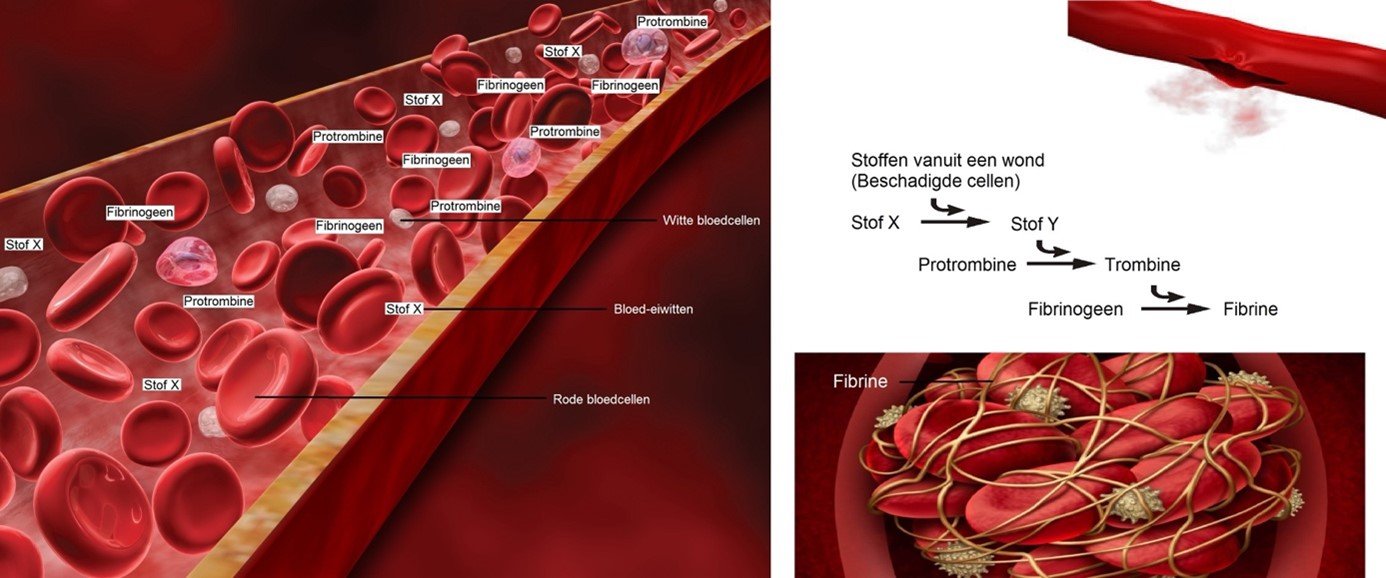
Fibrinogeen is een kort, oplosbaar eiwit dat door de lever wordt gesynthetiseerd en in onze bloedbaan vrijkomt. Als reactie op een verwonding of vaatschade komt het enzym trombine vrij. Trombine activeert de trombocyten (bloedplaatsjes) die dan aan elkaar en aan de vaatwand gaan plakken. Bovendien zet trombine het fibrinogeen om in fibrine. Dit fibrine is een lang draadvormig eiwit dat de wond dicht doordat er bloedcellen achter blijven hangen en doordat fibrine de wond samentrekt (Foto1)
Dit systeem is een essentieel onderdeel van onze defensieve reactie, waardoor we kunnen genezen van wonden om verder bloedverlies te voorkomen. Deze fibrinestolsels worden later weer afgebroken door het enzym plasmine. Hierbij komen bijproducten vrij zoals het D-Dimeer-eiwit, dat vaak wordt gemeten in het laboratorium om te controleren op recente stolselontwikkeling.
Foto 1 Normale bloedstolling (https://www.biologielessen.nl)
Abnormale bloedstolling bij acute COVID-19 infectie
Al vroeg in de pandemie realiseerden onderzoekers dat patiënten met een acute COVID-19-infectie vaak abnormale bloedstolling vertoonden, met name rond de rol van het stollingseiwit fibrinogeen. Vreemd genoeg vertoonden patiënten met acute COVID-19 paradoxale syndromen: sommige patiënten vertoonden al vroeg in de ziekte een hoge stollingsactiviteit die werd gekenmerkt door verhoogd fibrinogeen en andere stollingsfactoren, voordat ze doorgroeiden tot een ernstiger ziektetoestand die werd gekenmerkt door overmatig bloeden. De Zuid-Afrikaanse wetenschapper Resia Pretorius en haar researchgroep, gespecialiseerd in gestoorde vaatwandfunctie en abnormale stolling, veronderstellen dat beide verschijnselen het gevolg zijn van een abnormale: upregulatie van fibrine en fibrinogeen kan stolselvorming veroorzaken en de vaatwand beschadigen, terwijl down-regulatie het tegenovergestelde effect kan hebben. Ons lichaam heeft verschillende homeostatische mechanismen om zich aan te passen aan uitdagingen zoals infecties. Maar deze reacties kunnen te ernstig slingeren en leiden tot diverse gevolgen.
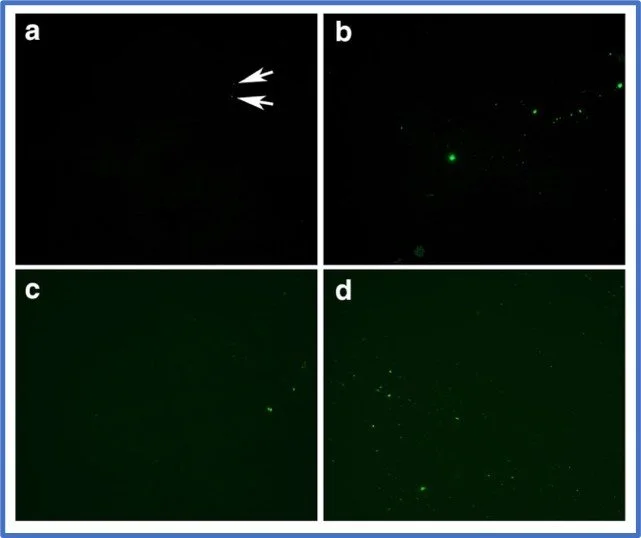
In een baanbrekende studie tegen het einde van 2020 toonden deze wetenschappers aan dat abnormale zogenaamde amyloïde vormen van het stollingseiwit fibrine konden worden geïsoleerd uit het bloed van patiënten met acute COVID-19 (4). Om de bloedklontjes te visualiseren wordt een bloedmonster gecentrifugeerd om het plasma te scheiden van de zwaardere bloedcellen en bloedplaatjes. Het "bloedplaatjesarme" plasma (“platelet poor plasma”, PPP) wordt vervolgens op een glasplaatje uitgesmeerd en behandeld met een fluorescerende kleurstof die selectief amyloïde eiwitten labelt. Het resulterende signaal wordt bekeken met een fluorescentie microscoop. Foto 2 laat zien dat in het bloed van gezonde vrijwilligers (verzameld vóór de Covid pandemie) vrijwel geen abnormale amyloïde eiwitten aanwezig zijn, terwijl in het bloed van Covid-19 patiënten grotere en kleinere deeltjes van het amyloïde fibrine zichtbaar zijn.
Foto 2 (4) Bloed (PPP) van gezonde vrijwilligers (a,b,c,d) en van patiënten met acute Covid-19 (e,f,g,h)
Interessant is dat dit abnormale fibrine, weliswaar in mindere mate, ook werd gezien bij patiënten met diabetes mellitus type 2 en bij andere ziekten zoals chronisch vermoeidheidssyndroom, Ziekte van Alzheimer en Parkinson. Dit betekent dat het amyloïde fibrine niet een uniek fenomeen is voor Covid-19 en zelfs niet voor infectieziekten. Een groot verschil is volgens Pretorius wel dat COVID microstolsels veel moeilijker afbreekbaar zijn. (4,7)
Wat betekent nu de aanwezigheid van deze amyloïde ofwel verkeerde gevouwen fibrine? De standaard fibrine is een fysieke verschuiving in zijn structuur ondergaan om een klonterige, plakkerige puinhoop te vormen in plaats van de goed geordende vellen die we verwachten te zien tijdens normale stolselvorming. Hun abnormale structuur maakt ze moeilijk afbreekbaar en bovendien hebben amyloïde eiwitten het vermogen om zichzelf te verspreiden door dezelfde verandering in eiwitstructuur te induceren naar andere eiwitten die ze tegenkomen.
Abnormale bloedstolling bij Long COVID patiënten
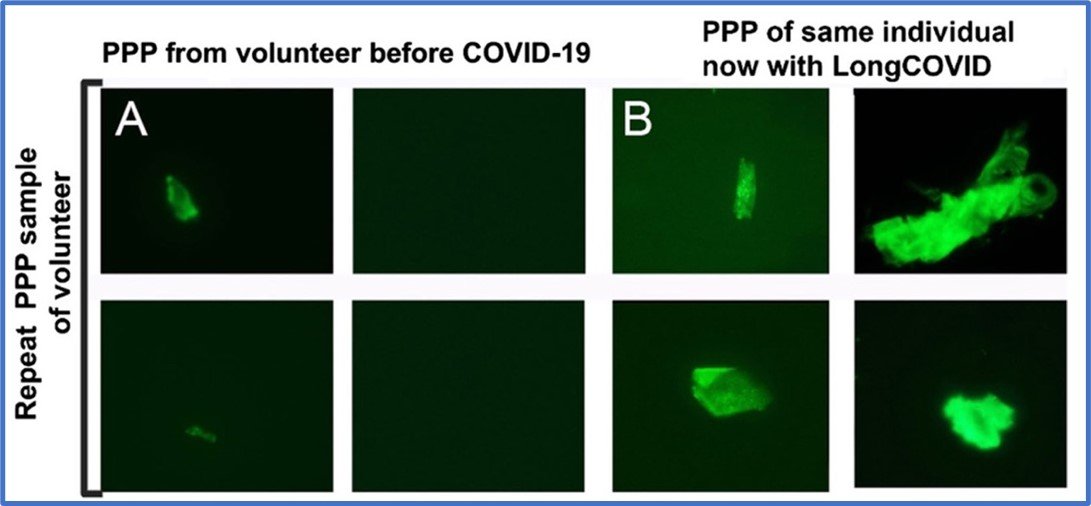
In een andere studie onderzochten Pretorius en haar collega’s (3) met vergelijkbare technieken de stolling bij 11 patiënten met Long COVID (LC). Ze vonden verschillende afwijkingen bij elke patiënt. Foto 3 toont het resultaat verkregen van één vrijwilliger met LC bij wie een eerder bloedmonster van vóór COVID-19 beschikbaar was ter vergelijking. De aanwezigheid van microstolsels zijn duidelijk zichtbaar in het “LC-bloed”, terwijl deze klontertjes nauwelijks aanwezig zijn in het bloed van dezelfde patiënt vóórdat hij geïnfecteerd werd. Ook in New York onderzocht David Putrino (een Long COVID wetenschapper) het bloed van enkele tientallen LC-patiënten op microstolsels. Hij vond eveneens in alle bloedmonsters de aanwezigheid van deze stolsels (7).
Foto 3 (5) Bloed (PPP) van een vrijwilliger van vóór COVID-19 en later met Long COVID
Naast het aantonen van aanwezigheid van amyloïde fibrine, probeerde men ook de samenstelling van deze microklonters te analyseren (5). Om dit te doen, gebruikte men het bloed van long-COVID patiënten en vergeleken dit met het bloed van acute COVID-19 patiënten en gezonde controles. De bloedmonsters stelden ze bloot aan een enzym dat eiwitten afbreekt. De afbraakresistente eiwitten die vastzaten in het stolsel kunnen vervolgens worden geïsoleerd en verder geanalyseerd. Door het opsplitsen van deze eiwitten kunnen de fysieke kenmerken worden geanalyseerd. Via deze geavanceerde “proteomics” benadering werd duidelijk dat deze microklonters ontstekingseiwitten bevatten zoals plasminogeen, α2-antiplasmine, von Willebrand-factor en C-reactief eiwit. Belangrijk is dat verschillende van deze eiwitten werden gevonden in bloedmonsters van Long-COVID patiënten, maar afwezig waren in die van patiënten met acute COVID-19. Dit duidt op een overlappende maar ook verschillende pathologische toestand voor Long-COVID versus acute COVID-19.
De rol van het spike eiwit op de bloedstolling
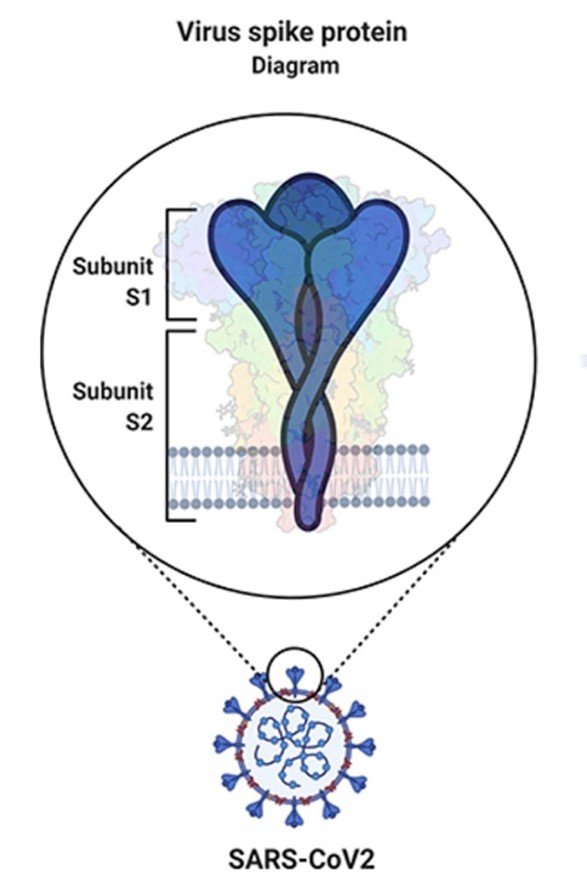
Iedereen kent inmiddels de mooie vorm van het Coronavirus met een krans (“corona” in het Latijn) van uitsteeksels: spike-eiwitten genaamd. Deze spike-eiwitten (Figuur 1) gebruikt het virus om de gastheercel binnen te dringen. Eenmaal ín de cel wordt het virale genoom (de genetische code) gebruikt om de gastheercel te kapen en zich te vermenigvuldigen. Het spike-eiwit bestaat uit 2 delen: het S1-deel bindt rechtstreeks aan zijn gastheerreceptor en het S2-deel is aan het membraan verankerd en zorgt voor binnendringen van de gastheercel. In de meeste gevallen bindt het spike-eiwit aan de ACE2-receptor (angiotensine-converterend enzym 2-receptor). ACE2 komt onder meer tot expressie op de celmembranen van het epitheel (binnenbekleding) van onze longen, luchtwegen en bloedvaten.
Interessant is dat het S1-deel van het spike-eiwit ook via geïnfecteerde cellen vrij in de algemene bloedsomloop terecht kan komen. De vraag is nu: kan spike-eiwit stollingsvorming beïnvloeden?
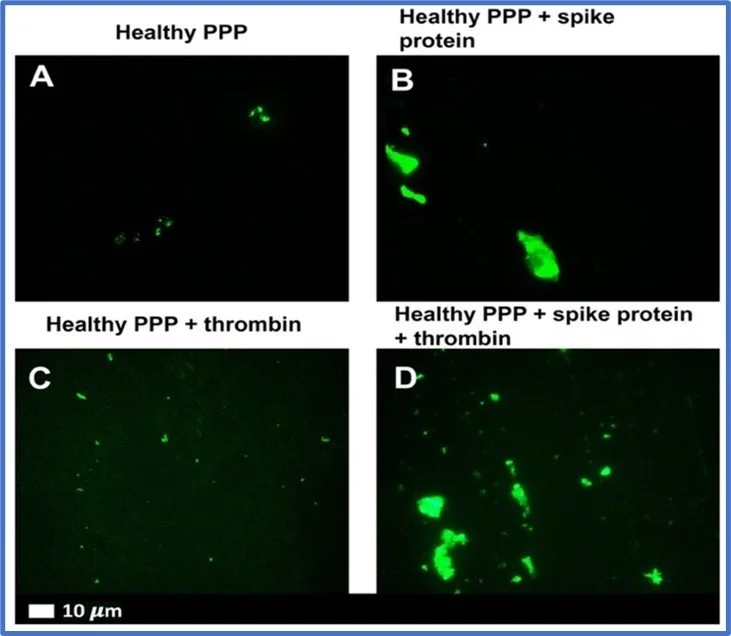
Om deze vraag te beantwoorden, isoleerden Grobbelaar et al. (6) bloedplaatjesarm plasma (PPP) van gezonde donoren en behandelden de bloedmonsters met geïsoleerd S1-eiwit. Ze ontdekten dat een korte behandeling met S1-spike voldoende was om abnormale stolling te veroorzaken, met of zonder gelijktijdige blootstelling aan trombine (een enzym dat stolling veroorzaakt als een natuurlijk onderdeel van onze stollingscascade).
Figuur 1 overgenomen van Grobbelaar et al. 2021 (6)
Foto 4 (6) Bloed (PPP) van gezonde vrijwilliger vóór (A,C) en na toediening van spike-eiwit (B,D)
Ook bleek dat het spike-eiwit in staat is bloedplaatjes te activeren. De stolsels die werden gevormd in aanwezigheid van S1-spike-eiwit waren groter dan die in gezonde bloedmonsters, en leken in plaats daarvan meer op die in bloedmonsters van patiënten met acute COVID-19.
Vaccinatie en bloedstolling
In de mRNA vaccins zit ook het S1-gedeelte van het coronavirus spike-eiwit, of het genetisch materiaal dat daarvoor codeert. Dit betekent dat ook door vaccinatie het spike-eiwit de stolling zou kunnen stimuleren. Sommige personen kunnen inderdaad vatbaar zijn voor dit effect. Belangrijk is dat COVID-19-infectie een veel hogere risicofactor blijft voor het ontwikkelen van Long COVID dan vaccinatie voor COVID-19.
Microstolsels als potentiële diagnostische biomarker
In deze eerste onderzoeken over de relatie tussen stolling en Long COVID werd in 100% van de LC-patiënten deze microstolsels gevonden. Dan vraag je je af zou de aanwezigheid van microklonters kunnen dienen als biomarker voor Long COVID? Kan het worden gebruikt om patiënten te diagnosticeren of de ernst van hun aandoening te meten?
Tot nu toe is alleen in kleine groepen LC-patiënten de aanwezigheid van microstolsels aangetoond. Voor dit onderzoek zijn specifieke technieken en technici nodig, die momenteel nog niet standaard zijn in pathologielaboratoria. Het proces is prima voor enkele tientallen bloedmonsters tegelijk, maar om te bepalen of deze stolsels diagnostisch kunnen zijn, zullen duizenden monsters moeten worden genomen van zowel LC-patiënten als gezonde controles. In New York werken David Putrino (een fysiotherapeut gepromoveerd in de neurowetenschappen) en Akiko Iwasaki (hoogleraar immunologie en ME/CVS/LC-wetenschapper) samen aan een studieplan om honderden LC-patiënten te testen op deze microstolsels (7).
De rol van microstolsels bij het ontstaan van Long COVID
Deze reeks onderzoeken laat zien dat SARS-CoV-2-infectie, mogelijk via het spike-eiwit, de vorming van abnormale microklonters kan veroorzaken die resistent zijn tegen afbraak. Onder normale omstandigheden is het enzym plasmine verantwoordelijk voor de afbraak van fibrine. Het inactieve plasminogeen dat circuleert in ons bloed wordt onder invloed van fibrine omgezet in plasmine. Als in een langdurige COVID-tijd vooral abnormaal gevouwen (ofwel amyloïde) fibrine aanwezig is, zal meer fibrine zich blijven ophopen tot een amyloïde, moeilijk afbreekbare vorm in plaats van via de normale weg te worden afgebroken door plasmine. Dit zou kunnen leiden tot een “positieve terugkoppeling” ofwel een sneeuwbaleffect, waarbij de balans tussen stollings- en fibrinolyseprocessen ontregeld kan raken.
Dit roept de vraag op: zou dit een rol kunnen spelen bij Long COVID (LC)?
Net zoals we nog steeds niet weten of microstolsels kunnen dienen als een definitief diagnostisch hulpmiddel voor LC, begrijpen we ook niet volledig hoe deze stollingsstoornis bij kan dragen aan de pathofysiologie van LC. De microstolsels zijn niet groot genoeg om grotere bloedvaten te blokkeren, maar zouden de kleine haarvaten wel kunnen afsluiten. Deze vaatjes vormen de belangrijkste plaats van zuurstofuitwisseling voor onze weefsels. Afsluiting ervan geeft geen levensbedreigende symptomen, maar zou wel degelijk verschillende orgaanfuncties kunnen aantasten (7). Ook de waarneming dat het aantal microstolsels in het bloedmonster van een LC-patiënt correleert met de ernst van zijn cognitieve klachten pleit voor een duidelijke rol van deze microstolling bij het ontstaan van LC (7).
Er zijn verschillende overtuigende theorieën over hoe deze microstolsels pathologische processen kunnen blijven aansturen na een acute infectie. Volgens Moen, Pretorius en Putrino (3,7) vormt deze microstolselhypothese een overtuigend onderliggend mechanisme dat meerdere theorieën met elkaar verweeft. Hieronder worden hun speculaties hierover in het kort besproken.
· Metabole disfunctie: Afsluiting van de haarvaatjes door microstolsels kan leiden tot aanhoudende cycli van zuurstoftekort, wat uiteindelijk resulteert in een toestand van oxidatieve stress. Metabole disfunctie ofwel verstoorde stofwisseling is sterk betrokken bij myalgische encefalomyelitis (ME), een postvirale aandoening die wordt gekenmerkt door ernstige vermoeidheid en inspanningsintolerantie. Veel LC-patiënten ontwikkelen ME, en ME-patiënten zonder voorgeschiedenis van COVID-infecties vertoonden ook microstolsels.
· Ontregeld immuunsysteem: sommige onderzoeken hebben aangetoond dat witte bloedcellen, die de afweerreacties in het bloed reguleren, metabole en functionele verstoringen vertonen bij LC-patiënten. Bovengenoemde metabole disfunctie zou kunnen verklaren waarom deze cellen vaak "functioneel uitgeput" lijken te zijn bij Long COVID.
· Vaatwandbeschadiging: aanhoudende metabole disfunctie en ontregelde stollingscascades kunnen schade aan het endotheel (binnenbekleding van bloedvaten) veroorzaken, zoals verlies van capillaire dichtheid en resulterende zenuwbeschadiging.
· Virale persistentie: studies hebben aangetoond dat het SARS-CoV-2-virus of deeltjes hiervan lange tijd in het weefsel van sommige individuen kan blijven bestaan. De hierdoor aanhoudende blootstelling aan het spike-eiwit kan microstolsel-gerelateerde schade blijven veroorzaken. Dit zou echter ook suggereren dat microklonters niet de onderliggende oorzaak zijn van Long COVID.
· Auto-immuniteit: de langdurige aanwezigheid van de moeilijk afbreekbare microstolsels kan een auto-immuunreactie oproepen. Hierbij worden auto-antistoffen gevormd die zich keren tegen het eigen gezonde weefsel met allerlei schadelijke gevolgen van dien.
Mogelijke behandeling van deze microstolsels
In een pilotstudie behandelde Pretorius en haar team gedurende een maand lang 24 LC-patiënten met een combinatie van het antistollingsmiddel Apixaban en “duale anti-plaatjestherapie”. Hierbij werd een afname gezien in de microstolsels en in de plaatjesactiviteit. Meer klinische studies zijn nodig om na te gaan in hoeverre antistollings- en antiplaatjestherapie werkzaam kunnen zijn bij Long COVID. (7)
Bronnen
3. Moen J. Deep dive: microclots in long COVID 2023. Long CIVID Research Breakdown. https://lcbreakdown.substack.com/p/deep-dive-microclots-in-long-covid
4. Pretorius E, Venter C, Laubscher GJ et al. Prevalence of readily detected amyloid blood clots in ‘unclotted’ Type 2 Diabetes Mellitus and COVID-19 plasma: a preliminary report Cardiovasc Diabetol 2020;19, 193. https://doiorg/101186/s12933-020-01165-7
5. Pretorius E, Vlok M, Venter C et al. Persistent clotting protein pathology in Long COVID/Post-Acute Sequelae of COVID-19 (PASC) is accompanied by increased levels of antiplasmin Cardiovasc Diabetol 2021;20, 172. https://doi.org/10.1186/s12933-021-01359-7
6. Grobbelaar LM, Venter C, Vlok M, et al. SARS-CoV-2 spike protein S1 induces fibrin(ogen) resistant to fibrinolysis: implications for microclot formation in COVID-19. Biosci Rep. 2021;41(8):BSR20210611. doi:10.1042/BSR20210611
7. Runwal P. “Microclots” could help solve the long COVID puzzle. 2023 https://www.nationalgeographic.com/magazine/article/microclots-pots-long-covid-treatment-diagnosis